
治験事務局から患者さんへ
治験事務局から患者さんへ
「くすり」は私たちの健康と福祉に欠かせないもののひとつです。
そして医療は「くすり」の開発によって大きく進歩してきました。 「くすり」は人類共通の財産であり、人々の健康維持に大いに役立っています。
しかし、今日でも治すことのできない病気はたくさんあり、これからも新しい「くすり」の開発が必要とされています。

新しい薬が世に出るまで
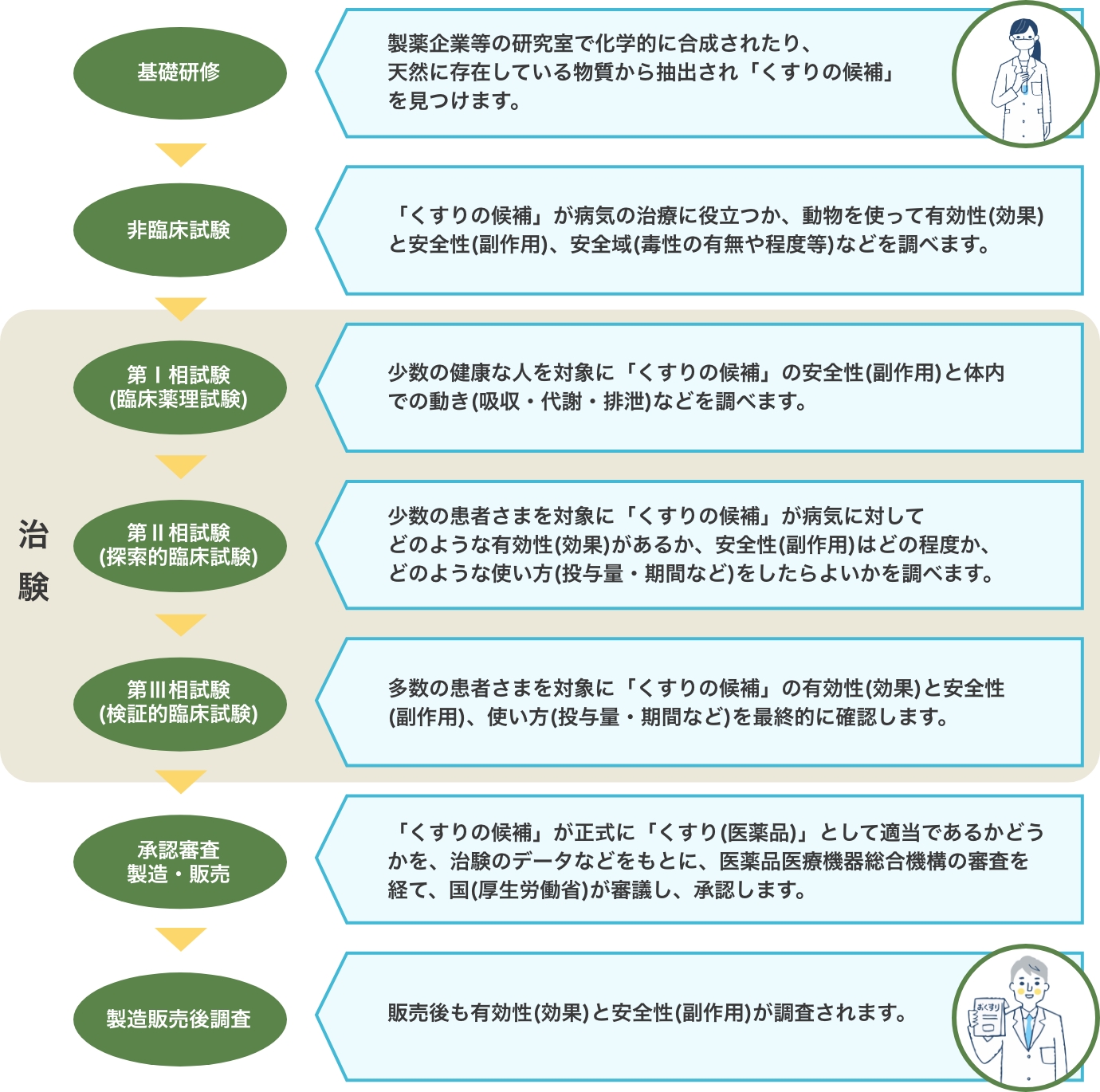
新しい「くすり」が世に出るまでには、長い年月がかかります。
「くすり」は「くすりの候補」について、有効性(効果)と安全性(副作用)が調べられ、人々の命や健康に役立つことが証明されたものだけが国(厚生労働省)から「くすり(医薬品)」として認められ、はじめて世に送り出されます。
くすりと治験

新しい「くすり」は、非臨床試験(動物実験)終了後、すぐに発売されるわけではありません。
なぜなら、動物と人では体の仕組みが異なるため動物実験のデータをそのまま人に当てはめることができないからです。もし、人での有効性(効果)や安全性(副作用)を調べずに「くすり」として広く使われることになれば、病気を治せないばかりか、多くの患者さんに思わぬ副作用が起こることにもなりかねないのです。
「くすりの候補」が「くすり」となるためには、人において有効性(効果)と安全性(副作用)を調べなければなりません。
このように人での有効性や安全性などについて調べる試験のことを一般に「臨床試験」といい、「くすりの候補」を国(厚生労働省)から「くすり(医薬品)」として認めてもらうために行う臨床試験を、特に「治験」といいます。
現在使われている「くすり」も、先人のご協力のもとに誕生した、言わば「先人からの贈り物」なのです。「治験」とは、新しい「くすり」を次の世代に贈るための試験なのです。

治験を行うときのルール
治験では「くすりの候補」が実際に人に使用されるため、治験に参加していただく方の人権や安全性が守られなければなりません。また同時に「くすりの候補」の有効性(効果)と安全性(副作用)は科学的に適正な方法で調べなければなりません。
そのため、治験の実施に関して、国(厚生労働省)より厳しい基準「医薬品の臨床試験の実施の基準(GCP)」が定められています。
- 治験の計画・内容について、病院内に設置された治験審査委員会(IRB)※で、治験に参加される方の人権や安全性および科学性において問題がないかを審査します。
- 治験を行う医師は、治験を始める前に、治験に参加していただく方に、治験の内容(目的、方法、「くすりの候補」の予想される効果や副作用等)を十分に説明し、文書による同意を得ることが義務付けられています。
- 治験依頼者(製薬会社)は、治験がGCPに沿って行われているかを確認(モニタリングおよび監査)することが義務付けられています。
治験審査委員会(IRB)とは
当院に設置された委員会で、治験の計画・内容が倫理的・科学的に妥当であるか、治験の実施状況に問題がないかを審査します。
また、治験に参加される方の人権と安全性を保護するため、医学・歯学・薬学等の専門家以外の人や、当院とは利害関係のない人を加えて構成されています。
Copyright © 2021
独立行政法人 労働者健康安全機構
神戸労災病院 ALL Rights Reserved.


